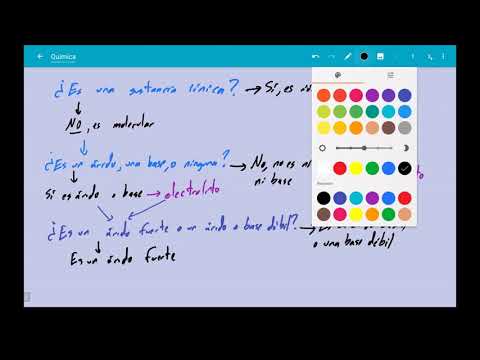
Para identificar si un electrolito es fuerte o débil, se debe evaluar su capacidad para disociarse en iones en una solución acuosa. Los electrolitos fuertes se disocian completamente en iones, lo que significa que todas las moléculas se separan en iones positivos y negativos. Por otro lado, los electrolitos débiles solo se disocian parcialmente, lo que resulta en una menor cantidad de iones presentes en la solución. Una forma común de identificar un electrolito fuerte es observar si la sustancia se presenta como un ácido fuerte o una base fuerte en la tabla de constantes de acidez o bases. Por el contrario, los electrolitos débiles son más comunes en forma de ácidos débiles o bases débiles.
¿Cuál es la manera de reconocer un electrolito?
La forma de reconocer un electrolito se basa en realizar un perfil de electrolitos, el cual consiste en determinar cada uno de los componentes por separado, como el sodio, potasio, cloruro y bicarbonato. Además, se utiliza una prueba llamada “anión gap” para relacionar estos resultados y obtener un valor calculado. Esta información es fundamental para evaluar el equilibrio de electrolitos en el organismo y poder diagnosticar posibles desequilibrios o alteraciones.
El perfil de electrolitos permite evaluar el equilibrio de los componentes fundamentales en el organismo, como el sodio, potasio, cloruro y bicarbonato. La prueba “anión gap” complementa esta información al relacionar estos resultados y obtener un valor calculado. Estos análisis son esenciales para diagnosticar desequilibrios o alteraciones en los electrolitos del cuerpo.
¿Cuál es la manera de distinguir entre un electrolito y un no electrolito?
La manera de distinguir entre un electrolito y un no electrolito se basa en su capacidad de conducir electricidad en disolución. Los electrolitos son sustancias que se disocian en iones y, por lo tanto, pueden conducir la corriente eléctrica. Por otro lado, los no electrolitos son sustancias que no se disocian en iones y, por lo tanto, no pueden conducir la electricidad cuando están disueltas. Esta diferencia fundamental en su comportamiento eléctrico permite identificar y clasificar las sustancias en electrolitos y no electrolitos.
En resumen, la capacidad de un compuesto para disociarse en iones y conducir la electricidad en disolución es lo que determina si es un electrolito o un no electrolito. Esta distinción es fundamental para comprender el comportamiento eléctrico y la clasificación de las sustancias.
¿Cuál es la diferencia entre un electrolito fuerte y uno débil y cuáles son algunos ejemplos de cada uno?
Los electrolitos fuertes son aquellos que se disocian completamente en agua, como el ácido clorhídrico (HCl) y el cloruro de sodio (NaCl), mientras que los electrolitos débiles, como el ácido acético, solo se disocian parcialmente. Los electrolitos fuertes pueden tener propiedades ácidas o básicas, y se les llama ácidos o bases fuertes, respectivamente. Algunos ejemplos de electrolitos fuertes son el ácido sulfúrico (H2SO4) y el hidróxido de sodio (NaOH), mientras que el ácido acético y el amoníaco (NH3) son ejemplos de electrolitos débiles.
Los electrolitos fuertes, como el HCl y el NaCl, se disocian completamente en agua, mientras que los electrolitos débiles, como el ácido acético, solo se disocian parcialmente. Estos electrolitos fuertes pueden tener propiedades ácidas o básicas, y se les denomina ácidos o bases fuertes, respectivamente. Ejemplos de electrolitos fuertes son el H2SO4 y el NaOH, mientras que el ácido acético y el NH3 son ejemplos de electrolitos débiles.
Claves para diferenciar entre electrolitos fuertes y débiles en soluciones acuosas
Los electrolitos en soluciones acuosas se clasifican en fuertes y débiles según su capacidad de disociación en iones. Los electrolitos fuertes se disocian completamente en iones en solución, mientras que los electrolitos débiles solo se disocian parcialmente. Esta diferencia se debe a la fuerza de sus enlaces iónicos y su capacidad para interaccionar con el solvente. La identificación de los electrolitos fuertes y débiles es fundamental para comprender y predecir el comportamiento de las soluciones acuosas en diferentes procesos químicos.
Se clasifican los electrolitos en soluciones acuosas en fuertes y débiles, dependiendo de su disociación en iones. Esta disociación puede ser completa o parcial, y se debe a la fuerza de los enlaces iónicos y su interacción con el solvente. Identificar los electrolitos fuertes y débiles es esencial para comprender y predecir el comportamiento de las soluciones en procesos químicos.
El arte de identificar electrolitos: cómo distinguir entre los fuertes y los débiles
En el campo de la química, la identificación de electrolitos es esencial para comprender la conductividad eléctrica de las soluciones. Los electrolitos fuertes se disocian completamente en iones en el agua, mientras que los débiles solo se disocian parcialmente. Para distinguir entre ellos, se utilizan diferentes pruebas, como la conductividad eléctrica y la capacidad para formar precipitados. Estas técnicas permiten a los científicos determinar la naturaleza y concentración de los electrolitos presentes, lo que es fundamental para diversos campos, incluyendo la medicina y la industria.
Se utilizan pruebas de conductividad eléctrica y formación de precipitados para identificar y determinar la naturaleza y concentración de los electrolitos en soluciones, lo cual es esencial en campos como la medicina y la industria.
Electrolitos: ¿cómo reconocer los compuestos iónicos más potentes?
Los electrolitos son compuestos iónicos que se disocian en solución acuosa y son fundamentales para el funcionamiento correcto de nuestro organismo. Sin embargo, no todos los electrolitos son igual de potentes. Algunos, como el cloruro de sodio, son altamente efectivos para mantener el equilibrio de líquidos y la función muscular. Por otro lado, compuestos como el cloruro de potasio son menos potentes y se utilizan con mayor frecuencia en situaciones específicas. Reconocer los electrolitos más potentes es esencial para garantizar una correcta hidratación y un buen funcionamiento del organismo.
Los electrolitos más efectivos para mantener el equilibrio de líquidos y la función muscular son compuestos iónicos como el cloruro de sodio, mientras que el cloruro de potasio se utiliza en situaciones específicas. Es crucial reconocer los electrolitos más potentes para una correcta hidratación y un óptimo funcionamiento del organismo.
Electrolitos en acción: descifrando los secretos de su fuerza y debilidad
Los electrolitos son sustancias que se encuentran en nuestro cuerpo y desempeñan un papel crucial en el funcionamiento de nuestras células y órganos. Son responsables de mantener el equilibrio de líquidos en nuestro organismo y de transmitir señales eléctricas entre las células nerviosas y musculares. Sin embargo, un desequilibrio en los niveles de electrolitos puede tener consecuencias graves para nuestra salud. Es importante entender cómo funcionan los electrolitos y cómo mantener un equilibrio adecuado para asegurar un buen funcionamiento de nuestro cuerpo.
Los electrolitos se encuentran en nuestro cuerpo y son esenciales para el correcto funcionamiento de nuestras células y órganos. Mantienen el equilibrio de líquidos y transmiten señales eléctricas entre las células nerviosas y musculares. Un desequilibrio en los niveles de electrolitos puede tener graves consecuencias para nuestra salud. Es fundamental entender su funcionamiento y mantener un equilibrio adecuado para garantizar un buen funcionamiento del cuerpo.
En conclusión, la identificación de un electrolito como fuerte o débil es esencial para comprender cómo se comporta en una solución acuosa. Un electrolito fuerte es aquel que se disocia completamente en iones en una solución, lo que significa que libera una gran cantidad de iones en el agua. Por otro lado, un electrolito débil solo se disocia parcialmente, liberando solo una pequeña cantidad de iones en la solución. Para identificar un electrolito fuerte, se pueden observar ciertas características como su capacidad para conducir electricidad de manera eficiente, su capacidad para reaccionar con otros compuestos y su alta solubilidad en agua. En contraste, los electrolitos débiles tendrán una conductividad eléctrica más baja, una menor capacidad para reaccionar y una menor solubilidad. Es importante destacar que la identificación precisa de un electrolito como fuerte o débil es fundamental para comprender su comportamiento en una solución y su influencia en reacciones químicas y procesos biológicos.